对革兰氏阴性菌(G-)有效的抗生素有哪些?有何区别?
- 健康养生
- 6个月前
- 134
革兰氏阴性菌是医院获得性肺炎(HAP)和呼吸机相关肺炎(VAP)的重要病原体。近几十年来,在社区获得性肺炎(CAP),尤其是有潜在肺部疾病或既往抗生素治疗史的患者中,也有较高的发现比例。
革兰氏阴性菌肺炎,特别是多药耐药(MDR)和广泛耐药(XDR)革兰氏阴性菌肺炎,与患者更高的医疗成本、更长的住院时间和更高的死亡率显著相关,而这类肺炎的持续增多,已成为全球临床管理和公众健康方面的一项严重关切和挑战[1]。
传统上,革兰氏阴性菌(特别是其 MDR 菌株)感染的治疗十分困难,主要是因为现有的治疗方案,如氨基糖苷类和/或甘氨酰环素类药物有明显的缺点,包括不可忽视的毒性以及某些感染部位可能的次优药代动力学等。因此,开发出对该类感染更加安全有效的新型药物,一直是该领域的研究热点。
那么,革兰氏阴性菌肺炎该如何应对?临床上有那些新药可用或正在研发?这些新药又有那些效果和特点呢?让我们跟随 M 等人发表在近期《Eur Rev》杂志上的综述文章来了解一下吧[1]。
重视相关风险因素和风险患者的识别
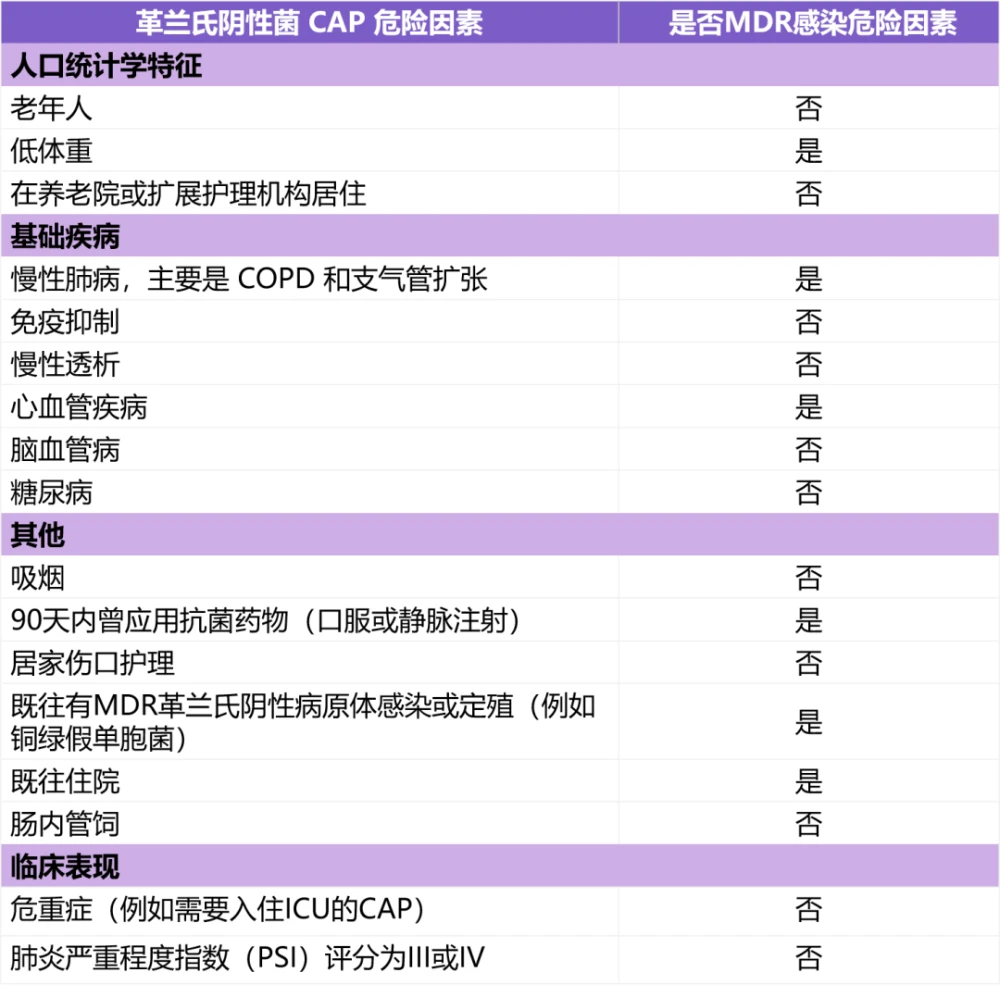
合理应用抗菌药物,避免抗生素滥用和治疗不足,是改善革兰氏阴性菌肺炎预后、减少 MDR 形成的重要环节,而认真识别革兰氏阴性菌 CAP 风险患者以及易发 MDR 感染的危险因素(表 1),是保证这一环节起效的前提和关键,值得所有临床工作者高度重视。
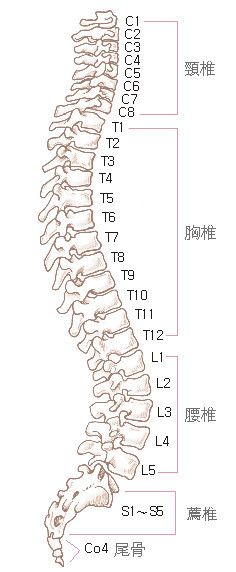
表 1 革兰氏阴性菌引起 CAP 的危险因素(包括(MDR)株感染)
部分新批准用于 G- 肺炎治疗的抗菌药物的特点和选择要点
表 2 部分新药对革兰氏阴性病原体的抗菌活性
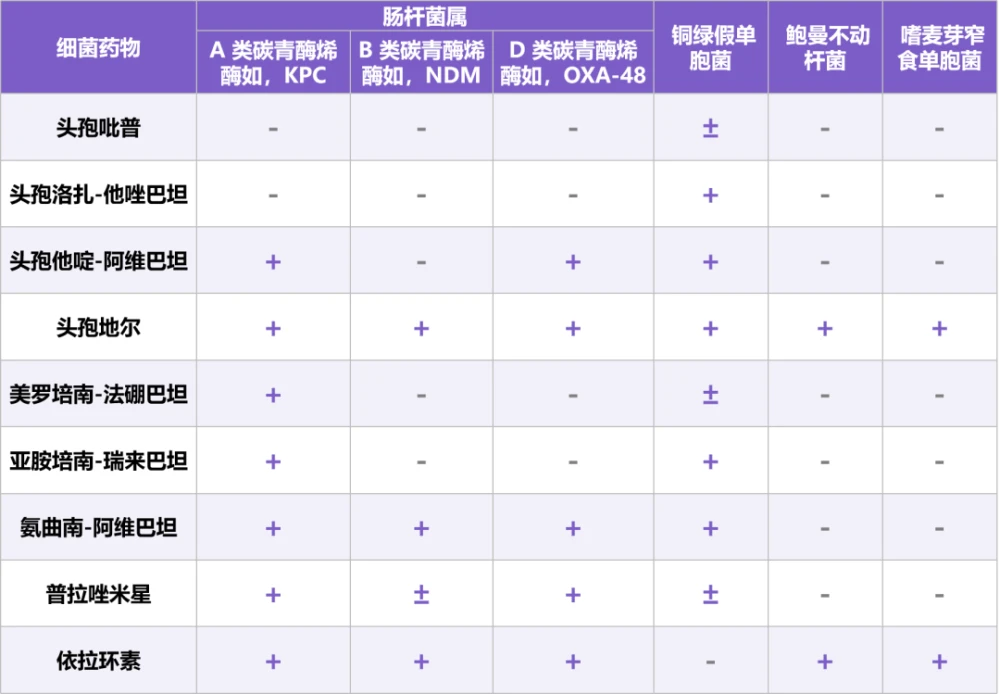
表注:+表示有活性,-表示无活性,±表示活性不固定。KPC = 肺炎克雷伯菌碳青霉烯酶;NDM = 新德里金属 β-内酰胺酶;OXA = OXA-β-内酰胺酶
1. 头孢吡普(,头孢比普,头孢托罗,头孢比罗):该药为第五代头孢菌素,已批准用于治疗 CAP 和 HAP,但不包括 VAP。如表 2 所示,头孢吡普对多种革兰氏阴性病原体(如流感嗜血杆菌、卡他莫拉菌、铜绿假单胞菌等)显示出强大活性,并能抑制 AmpC β 内酰胺酶(AmpC)。
但对产超广谱 β-内酰胺酶(ESBL)、碳青霉烯酶或金属 β-内酰胺酶(MBL)肠杆菌无效。头孢吡普对鲍曼不动杆菌、洋葱伯克霍尔德菌和嗜麦芽窄食单胞菌也无抗菌活性。
此外,头孢吡普对革兰氏阳性菌(如肺炎链球菌和耐甲氧西林金黄色葡萄球菌(MRSA)等)也有显著杀菌活性。
相关研究证实,头孢吡普治疗 CAP 的效果不劣于头孢曲松,对 HAP 的效果不劣于头孢他啶加利奈唑胺,但对于 VAP,未能证实其对头孢他啶加利奈唑胺方案的非劣效性。
头孢吡普的耐受性良好,最常见的不良反应是味觉障碍、恶心、呕吐和腹泻,其次是高渗血症和输液部位反应。
结论:鉴于头孢吡普的安全性和活性谱,其有望成为单药治疗革兰氏阴性菌所致 CAP 和 HAP 的一种可行性选择,尤其是在怀疑伴有 MRSA 感染时。
2. 头孢洛扎-他唑巴坦(-):该药是由改良头孢菌素(头孢洛扎)与 β-内酰胺酶抑制剂(他唑巴坦)组成的复方制剂。头孢洛扎对革兰氏阴性菌的多种耐药机制具有稳定性,包括 AmpC 的过度表达、孔蛋白丢失或药物外流泵。
是目前对抗铜绿假单胞菌,包括 MDR 或 XDR 菌株,最有效的 β-内酰胺类药物。
头孢洛扎-他唑巴坦对产 ESBL 肠杆菌也显示出较强活性,但对所有产碳青霉烯酶(例如 MBL 或丝氨酸碳青霉烯酶类)的菌株,包括铜绿假单胞菌和肠杆菌属无效,对鲍曼不动杆菌或嗜麦芽窄食单胞菌也无效。
与头孢他啶、亚胺培南或环丙沙星比较,头孢洛扎-他唑巴坦对铜绿假单胞菌的最低抑菌浓度(MIC)低 8~16 倍。最近的一项监测研究证实,头孢洛扎-他唑巴坦对铜绿假单胞菌的敏感率(97.5%)高于头孢吡肟(83.6%)、头孢他啶(82.6%)、美罗培南(76%)或哌拉西林-他唑巴坦(77.7%),但不及粘菌素(99.9%)。
一项随机、双盲试验显示,头孢洛扎-他唑巴坦对医院内肺炎(71% 为 VAP)的疗效不劣于美罗培南。其 28 天全因死亡率为 24.0% Vs 25.3%;临床治愈率为 54.0% Vs 53%。此外,也有研究显示,头孢洛扎-他唑巴坦对大肠杆菌,包括产 AmpC 和产 ESBL 菌株有高度活性,且在治疗耐药铜绿假单胞菌感染方面的效果优于多粘菌素或基于氨基糖苷类药物的方案,且急性肾损伤更少。
结论:头孢洛扎-他唑巴坦是治疗 MDR 或 XDR 铜绿假单胞菌所致 VAP 或 HAP 的首选药物,且在治疗产 ESBL 肠杆菌所致医院内肺炎方面,可作为碳青霉烯类药物有价值的替代品。
3. 头孢他啶-阿维巴坦(-):是由半合成第三代头孢菌素与新型非 β-内酰胺/β-内酰胺酶抑制剂组成的复方制剂。阿维巴坦可保护头孢他啶免受大部分类别 β-内酰胺酶的水解,包括 A 类(如 ESBL 和肺炎克雷伯菌碳青霉烯酶(KPC))、C 类(如 AmpC)和 D 类(如 OXA-48 酶类等)。但对 B 类 β-内酰胺酶无效,且对鲍曼不动杆菌、厌氧革兰氏阴性菌,以及革兰氏阳性球菌的活性较低。
有研究显示,头孢他啶-阿维巴坦对99%以上的肠杆菌菌株敏感,其 MIC90 为 0.5 μL/mL(较单用头孢他啶时的 MIC90 低 7 倍)。头孢他啶-阿维巴坦还保留了对于耐碳青霉烯(CR)肠杆菌菌株的活性,对 80% 的该类分离株表现出体外敏感性。此外,头孢他啶-阿维巴坦对 90% 的铜绿假单胞菌分离株敏感,其中包括 2/3 的头孢他啶不敏感菌株和 3/4 的 CR 菌株)。
有随机对照研究显示,头孢他啶-阿维巴坦治疗 HAP 和 VAP 的效果不劣于美罗培南,其临床治愈率为 68.8% Vs 73.0%;在 CE 人群中的治愈率为 77.4% Vs 78.1%。
而另一项新近的研究显示,与美罗培南相比,头孢他啶-阿维巴坦用于 HAP/VAP 住院患者时,临床治愈率更高,住院时间更短,生命年数和质量调整生命年数(QALYs)更高。虽然头孢他啶-阿维巴坦人均治疗成本估计会增加,但住院费用的降低和 QALYs 的收益可抵消这一影响。
结论:头孢他啶-阿维巴坦是目前治疗产 OXA-48 酶或 KPC 肠杆菌所致 HAP 或 VAP 的首选药物,且在治疗产 ESBL 肠杆菌或 CR 铜绿假单胞菌所致的医院内肺炎方面发挥作用。
4. 头孢地尔():该药是一种新的改良头孢菌素,具有组氨酸侧链和三价铁。这一结构有助于其渗透到细菌细胞中,进而通过与青霉素结合蛋白结合及抑制肽聚糖合成而抑制细胞壁合成。A、B、C、D 等各类 β-内酰胺酶均不影响头孢地尔活性。
一项大型多中心体外研究显示,头孢地尔对超过 99% 的肠杆菌(包括大肠杆菌、克雷伯菌属、柠檬酸杆菌属、肠杆菌属和沙雷氏菌属)的 MIC90 范围为 0.25~1 μg/mL;对铜绿假单胞菌、洋葱芽孢杆菌和嗜麦芽窄食单胞菌,头孢地尔的 MIC90 范围为 0.03~1 μg/mL,而对鲍曼假单胞菌,头孢地尔的 MIC90 范围为 1~4 μg/mL。
APEKS-NP 研究是一项多中心、双盲、3 期非劣效性试验。纳入 292 名患者,其中 VAP 123 名。分离的最常见的病原体是肺炎克雷伯菌,其次是铜绿假单胞菌和鲍曼不动杆菌。主要终点为治疗后 14 天的全因死亡率。结果显示,头孢地尔的疗效不劣于美罗培南加利奈唑胺,且在 28 天全因死亡率和安全终点方面的结果也无显著性差异。重要的是,在 16 个美罗培南 MIC > 64 μL/mL 的鲍曼不动杆菌菌株感染患者中,头孢地尔组的第 14 天全因死亡率为 0,明显优于美罗培南组(47%)。
-CR 是一项随机对照试验,共纳入了 152 名 CR 病原体感染患者,其中 45% 为医院内肺炎。分离的最常见的菌株是鲍曼不动杆菌(46%)、肺炎克雷伯菌(33%)和铜绿假单胞菌(19%)。结果显示,在改良意向性治疗(mITT)人群中,头孢地尔组的临床治愈率与采用最佳可用疗法(BAT)的对照组相当(50% VS 53%),在 HAP 和 VAP 亚组中也观察到类似结果。
遗憾的是,接受头孢地尔治疗的 HAP 和 VAP 患者的 28 天死亡率明显高于对照组(42% VS 18%),其感染病原体为主要为鲍曼不动杆菌。据此,相关部门已发布警告:头孢地尔单药治疗 CR 鲍曼不动杆菌感染时,全因死亡率增加。
结论:对于产 MBL 肠杆菌、MDX 铜绿假单胞菌和其他 CR 革兰氏阴性菌导致的 HAP 和 VAP,头孢地尔是一种值得关注的选择。但作为最新发布的抗生素之一,其有效性仍需深入研究。
5. 美罗培南-法硼巴坦(-):是由美罗培南与新型非 β-内酰胺类/β 内酰胺酶抑制剂法硼巴坦组成的复方制剂。法硼巴坦能保护美罗培南不被 A 类和 C 类 β 内酰胺酶降解,但对 B 类和 D 类 β-内酰胺酶的无效。与单用美罗培南相比,法硼巴坦对葡萄糖非发酵革兰氏阴性菌没有更多的体外活性。
一项比较分析发现,对临床分离的 KPC-阳性肠杆菌,美罗培南-法硼巴坦较美罗培南(单用)、头孢他啶-阿维巴坦、替加环素、头孢他啶(单用)、米诺环素、多粘菌素 B 和庆大霉素等显示出更强的体外活性。这在另一项监测研究中也得到证实,其中包括来自医院内肺炎患者的 1 万多株革兰氏阴性菌株,β-内酰胺类药物美罗培南-法硼巴坦对肠杆菌属菌株敏感性(98.0%)最高,对铜绿假单胞菌的敏感性(82.1%)也较高。
在 TANGO II 试验中,与 BAT 相比较,美罗培南-法硼巴坦对 CR 肠杆菌引起的严重感染有更高的临床治愈率(65.6%(21/ 32) Vs 33.3%(5/15))和微生物治愈率(65.6 %Vs 40.0%)。而且,接受美罗培南-法硼巴坦治疗的医院内肺炎或菌血症患者的 28 天全因死亡率更低(22.2% Vs 44.4%)。
而最近报告的一项研究也显示,美罗培南-法硼巴坦,治疗严重 CR 肠杆菌感染时,与头孢他啶-阿维巴坦有相似的临床成功率(69.2% Vs 62.0%)和死亡率。但在导致耐药性菌株的例数方面,头孢他啶-阿维巴坦组显著高于美罗培南-法硼巴坦组(3 例 Vs 0 例)。
结论:美罗培南-法硼巴坦应被视为目前治疗 CR 肠杆菌所致 HAP 或 VAP 的最佳治疗方案之一。
6. 亚胺培南-瑞来巴坦(-):瑞来巴坦是最近合成的一种 β-内酰胺酶抑制剂,用于恢复亚胺培南对产 A 类和 C 类 β-内酰胺酶革兰氏阴性菌株的活性,但不包括 B 类和 D 类。亚胺培南中加入瑞来巴坦,可显著恢复亚胺培南对大多数亚胺培南不敏感铜绿假单胞菌和产 KPC 肠杆菌的活性,但对鲍曼不动杆菌或嗜麦芽窄食单胞菌没有影响。
SMART 2017 监测项目显示,亚胺培南-瑞来巴坦对大多数肠杆菌的敏感性 > 90%(大肠杆菌、肺炎克雷伯菌和阴沟肠杆菌的敏感率分别为 99.6%、93.0% 和 97.8%,铜绿假单胞菌的敏感率也高达 90%)。重要的是,亚胺培南-瑞来巴坦还对大多数耐亚胺培南的铜绿假单胞菌分离株具有活性,尤其是当亚胺培南耐药是通过 AmpC 过度生成或 OprD 孔蛋白丢失介导时。
亚胺培南-瑞来巴坦治疗 HAP/VAP 的安全性和有效性已在两个 3 期非劣效性试验中获得验证。其中,-IMI-1 研究共纳入了 47 例亚胺培南不敏感病原体患者,包括 HAP/VAP(35.5%)、复杂尿路感染(25.8%)、急性肾盂肾炎(25.8%)和复杂腹腔内感染(12.9%),最常见病原体是铜绿假单胞菌(77.4%),其次是肺炎克雷伯菌 (12.9%)。
结果显示,亚胺培南-瑞来巴坦治疗的效果与粘菌素加亚胺培南组的效果相当,其微生物学改良意向性治疗(mMITT)人群的总体良好反应率、28 天良好临床反应率和 28 天死亡率分别为 71% Vs 70%、71% Vs 40% 和 10% Vs 30%。
IMI-2 研究纳入了 537 例 HAP/VAP 患者,肠杆菌属是最常见的致病病原体。主要终点是 mITT 人群的 28 天全因死亡率。其结果显示亚胺培南-瑞来巴坦的疗效不劣于哌拉西林-他唑巴坦。此外,在通气患者亚组和 II 评分 >15 分的患者亚组中,亚胺培南-瑞来巴坦治疗组的 28 天全因死亡率比哌拉西林-他唑巴坦组更低。
结论:对于产 KPC 肠杆菌或 CR 铜绿假单胞菌(非金属碳青霉烯酶)所致的疑似或确诊 HAP/VAP 的患者,应始终考虑使用亚胺培南-瑞来巴坦治疗。
7. 氨曲南-阿维巴坦(-):氨曲南是一种 β-内酰胺制剂,具有抗 MBL 活性,其单用时对大多数产 ESBL 和产 AmpC 细菌没有活性。而阿维巴坦可使氨曲南对大多数 MDR 革兰氏阴性菌(包括同时携带 A、C 和 D 类 β-内酰胺酶的细菌)保持稳定活性。
评估该药治疗严重革兰氏阴性菌感染有效性和安全性的关键试验,目前正在进行中。然而,在等待更有力的数据的同时,一项包括 102 例新德里产 MBL 肠杆菌血流感染患者的回顾性研究显示,头孢他啶-阿维巴坦联合氨曲南治疗与其他有体外活性的 BAT 方案相比较,具有较低的 30 天死亡率和 14 天临床失败率,以及更短的住院时间。
结论:基于现有数据,支持氨曲南联合头孢他啶-阿维巴坦用于产 MBL 菌株感染的治疗。
需要进一步研究的两种新药
1. 普拉唑米星(,普拉佐米星,普唑米星):该药是一种肠外氨基糖苷类药物,最近被 FDA 批准用于治疗复杂尿路感染,包括肾盂肾炎。与其他氨基糖苷类相比,普拉唑米星对氨基糖苷修饰酶的灭活保持稳定,对不太常见的 16s 核糖体核糖核酸甲基转移酶无活性。
相关研究表明,普拉唑米星对 95% 以上的肠杆菌分离株显示出良好的体外疗效(MIC50/90,0.5/1.0 mg/L),敏感性折点低于 2 mg/L。对于铜绿假单胞菌和不动杆菌属,其 MIC50/90 与阿米卡星相当。在肺炎患者中,普拉佐米星的药代动力学与其他氨基糖苷类抗生素相似,肺穿透性 ( 13 % ) 有限。
在一项随机双盲、3 期试验中,普拉佐米星与美罗培南或替加环素联合治疗 HAP/VAP 时的效果优于粘菌素与美罗培南或替加环素联合治疗,且不良事件和实验室异常的发生率及严重程度更低。普拉佐米星组和粘菌素组的主要终点事件(mMITT 人群中的 28 天全因死亡或具有临床意义的疾病相关并发症复合终点)发生率分别为 67%(3 名患者中有 2 例)和 40%(5 名患者中有 2 例),而不良事件和实验室异常发生率分别为 50% 和 81%。
尽管这些结果提示了普拉佐米星的疗效和安全性,但其目前尚未被 FDA 批准用于医院内肺炎的治疗,主要是由于试验纳入的的下呼吸道感染样本量太小(粘菌素组有 5 例 VAP,普拉佐米星组仅 3 例)。
2. 依拉环素():该药是一种新的四环素衍生物,作用于 30s 核糖体亚基以抑制细菌蛋白质合成。分子中的氟原子和吡咯烷乙酰胺基团有助于克服四环素的耐药性。目前有静脉和口服两种制剂。
依拉环素具有广谱性(可覆盖革兰氏阳性菌和革兰氏阴性菌,其中还包括难治菌,如耐舒巴坦的鲍曼不动杆菌)。但对铜绿假单胞菌没有活性。
药代动力学研究显示,静脉注射依拉环素后,肺泡上皮衬液和肺泡巨噬细胞中的药物浓度分别为血浆浓度 6 倍和 50 倍。
最近的一项回顾性研究显示,依拉环素治疗鲍曼不动杆菌肺炎时,与 BAT 治疗相比较,患者有较高的 30 天死亡率(33% Vs 15%)、较低的微生物治愈率(17% Vs 59%)和更长的机械通气持续时间(10.5 天 VS 6.5)天)相关。据此,依拉环素在用于肺炎治疗之前,还需有进一步的数据支持。
专家点评:

据最近估计,如果抗生素的耐药性不加以控制,到 2050 年,每年可能有多达 1000 万人死于耐药性。细菌应对抗生素的耐药机制多种多样,如药物作用靶点的改变、细胞膜通透性的降低和药物外排泵等,其中由降解酶介导的水解作用是临床上革兰氏阴性菌最常见的耐药机制。由于革兰氏阴性杆菌感染的治疗面临越来越大的挑战以及 MDR 菌株患者的治疗选择有限,这些新型抗生素的开发非常不容易,代表了重要的治疗进展。进行有针对性的药代动力学和临床研究对于将这些新药物应用于临床实践非常重要和迫切,希望在未来的几年里,不断的有新的药物丰富我们的抗菌药物谱,并通过优化管理,合理使用,最大限度延缓新型抗生素耐药性的发生。
参考文献:
1. M, Magnè F, DR, et al. New for Gram- . Eur Rev. 2022; 31: [DOI: 10.1183/.0119-2022].













有话要说...